QUÍMICA ANALÍTICA INSTRUMENTAL
Na cromatografia gasosa, o tempo de retenção é determinado por alguns parâmetros. Para substâncias com peso molecular próximo, apresenta maior tempo de retenção aquela substância que:
Tem menor pressão de vapor.
Possuir menor densidade.
For mais polar.
Mais interage com a fase estacionária.
Mais interage com a fase móvel.
Um aluno de química ao realizar uma análise para tentar separar um composto X e Y de uma amostra especifica, ele resolveu primeiramente testar a eluição dos compostos em vários solventes, utilizando a técnica de cromatografia em camada delgada, obtendo assim o seguinte resultado:
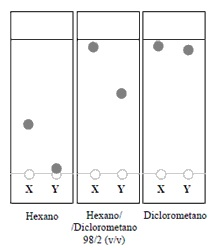 Entre os compostos mencionados, quem possui maior característica apolar?
Entre os compostos mencionados, quem possui maior característica apolar?
O composto X é mais polar que Y.
Somente o composto Y é polar.
Os compostos X e Y são polares.
O composto X é mais apolar que Y.
O composto Y é mais apolar que X.
0,573 g de amostra contendo NaNO3 foi diluída em um balão volumétrico de 100 mL. 1,0 mL dessa mistura foi transferida para um balão de 50 mL e o volume foi completado com um solvente inerte. Após a análise da solução presente no balão de 50 mL, obteve-se a emissão igual a 18. Qual alternativa abaixo contém o percentual correto de NaNO3 na amostra inicial. Dados: NaNO3 = 85 g/mol e Na = 23 g/mol.
50,3%
77,3%
85,2%
95,8%
39,0%
O Arsênio (As5+) é utilizado na fabricação de herbicidas comerciais. Para determinar o arsênio contido em uma amostra, foram realizadas várias medidas de padrões de As5+ obtendo a equação de curva analítica: Abs = 0,0305 CAs3+ + 0,0052, em que a concentração do arsênio está em mg/L. Uma amostra de 10,00 mL do herbicida foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,386. Qual a concentração de arsênio, em mg/L, presente no herbicida.
4755 mg/L de As5+
2641 mg/L de As5+
1248 mg/L de As5+
10825 mg/L de As5+
987 mg/L de As5+
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:
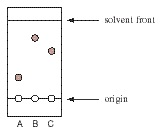
Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto B possui menor Rf e eluirá primeiro.
O composto A e B possui o mesmo valor de Rf.
O composto B possui o mesmo Rf do composto C.
O composto C possui menor Rf e eluirá primeiro.
O composto A possui menor Rf e eluirá por último.
Uma solução 7,25x10-5 mol/L de permanganato de potássio apresenta uma transmitância de 44,1% quando medida em uma célula de 2,10 cm no comprimento de onda de 525 nm. Calcule a absortividade molar do KMnO4.
7,25x103 L.mol-1.cm-1
8,90x103 L.mol-1.cm-1
2,34x103 L.mol-1.cm-1
1,25x103 L.mol-1.cm-1
3,58x103 L.mol-1.cm-1
A cromatografia fundamenta-se na migração diferencial dos componentes de uma mistura, o que ocorre devido a diferentes interações entre duas fases imiscíveis, sendo uma fase fixa que tem uma grande área superficial chamada fase estacionária, e a outra um fluído que se move através da fase estacionária sendo chamada de fase móvel. Na cromatografia líquida a fase móvel é líquida. (LANÇAS, 1993; DEGANI; CASS; VIEIRA, 1998).
Sendo assim, indique a alternativa que apresenta somente pontos vantajosos na aquisição do equipamento usado nesta técnica:
I- Boa sensibilidade
II- Versatilidade
III- Alta resolução;
IV- Resultados qualitativos;
V- Baixo custo de aquisição do equipamento.
Apenas I – IV – V
Apenas I – III – IV
Apenas I – II – III – IV
Apenas- I – III – V
Apenas II – IV – V
Usando a curva analítica de calibração para realizar a determinação O zinco (Zn2+) é adicionado à insulina para retardar sua velocidade de absorção para o fluxo sanguíneo. A concentração de zinco na insulina pode ser determinada por absorção atômica. Para determinação de Zn2+ em uma amostra, foram realizadas várias medidas convenientes de padrões de Zn2+, quando se obtém a seguinte equação para a curva analítica de calibração: Abs = 0,0149 CZn2+ + 0,0027 , em que CZn2+ está em mg/L. Uma amostra de 10,00 mL de insulina foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,595. Calcule a concentração, em g/L, de Zn2+ na insulina.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.
Tem menor pressão de vapor.
Possuir menor densidade.
For mais polar.
Mais interage com a fase estacionária.
Mais interage com a fase móvel.
Um aluno de química ao realizar uma análise para tentar separar um composto X e Y de uma amostra especifica, ele resolveu primeiramente testar a eluição dos compostos em vários solventes, utilizando a técnica de cromatografia em camada delgada, obtendo assim o seguinte resultado:
 Entre os compostos mencionados, quem possui maior característica apolar?
Entre os compostos mencionados, quem possui maior característica apolar?
O composto X é mais polar que Y.
Somente o composto Y é polar.
Os compostos X e Y são polares.
O composto X é mais apolar que Y.
O composto Y é mais apolar que X.
0,573 g de amostra contendo NaNO3 foi diluída em um balão volumétrico de 100 mL. 1,0 mL dessa mistura foi transferida para um balão de 50 mL e o volume foi completado com um solvente inerte. Após a análise da solução presente no balão de 50 mL, obteve-se a emissão igual a 18. Qual alternativa abaixo contém o percentual correto de NaNO3 na amostra inicial. Dados: NaNO3 = 85 g/mol e Na = 23 g/mol.

50,3%
77,3%
85,2%
95,8%
39,0%
O Arsênio (As5+) é utilizado na fabricação de herbicidas comerciais. Para determinar o arsênio contido em uma amostra, foram realizadas várias medidas de padrões de As5+ obtendo a equação de curva analítica: Abs = 0,0305 CAs3+ + 0,0052, em que a concentração do arsênio está em mg/L. Uma amostra de 10,00 mL do herbicida foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,386. Qual a concentração de arsênio, em mg/L, presente no herbicida.
4755 mg/L de As5+
2641 mg/L de As5+
1248 mg/L de As5+
10825 mg/L de As5+
987 mg/L de As5+
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:

Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto B possui menor Rf e eluirá primeiro.
O composto A e B possui o mesmo valor de Rf.
O composto B possui o mesmo Rf do composto C.
O composto C possui menor Rf e eluirá primeiro.
O composto A possui menor Rf e eluirá por último.
Uma solução 7,25x10-5 mol/L de permanganato de potássio apresenta uma transmitância de 44,1% quando medida em uma célula de 2,10 cm no comprimento de onda de 525 nm. Calcule a absortividade molar do KMnO4.
7,25x103 L.mol-1.cm-1
8,90x103 L.mol-1.cm-1
2,34x103 L.mol-1.cm-1
1,25x103 L.mol-1.cm-1
3,58x103 L.mol-1.cm-1
A cromatografia fundamenta-se na migração diferencial dos componentes de uma mistura, o que ocorre devido a diferentes interações entre duas fases imiscíveis, sendo uma fase fixa que tem uma grande área superficial chamada fase estacionária, e a outra um fluído que se move através da fase estacionária sendo chamada de fase móvel. Na cromatografia líquida a fase móvel é líquida. (LANÇAS, 1993; DEGANI; CASS; VIEIRA, 1998).
Sendo assim, indique a alternativa que apresenta somente pontos vantajosos na aquisição do equipamento usado nesta técnica:
I- Boa sensibilidade
II- Versatilidade
III- Alta resolução;
IV- Resultados qualitativos;
V- Baixo custo de aquisição do equipamento.
Apenas I – IV – V
Apenas I – III – IV
Apenas I – II – III – IV
Apenas- I – III – V
Apenas II – IV – V
Usando a curva analítica de calibração para realizar a determinação O zinco (Zn2+) é adicionado à insulina para retardar sua velocidade de absorção para o fluxo sanguíneo. A concentração de zinco na insulina pode ser determinada por absorção atômica. Para determinação de Zn2+ em uma amostra, foram realizadas várias medidas convenientes de padrões de Zn2+, quando se obtém a seguinte equação para a curva analítica de calibração: Abs = 0,0149 CZn2+ + 0,0027 , em que CZn2+ está em mg/L. Uma amostra de 10,00 mL de insulina foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,595. Calcule a concentração, em g/L, de Zn2+ na insulina.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.
O composto X é mais polar que Y.
Somente o composto Y é polar.
Os compostos X e Y são polares.
O composto X é mais apolar que Y.
O composto Y é mais apolar que X.
0,573 g de amostra contendo NaNO3 foi diluída em um balão volumétrico de 100 mL. 1,0 mL dessa mistura foi transferida para um balão de 50 mL e o volume foi completado com um solvente inerte. Após a análise da solução presente no balão de 50 mL, obteve-se a emissão igual a 18. Qual alternativa abaixo contém o percentual correto de NaNO3 na amostra inicial. Dados: NaNO3 = 85 g/mol e Na = 23 g/mol.

50,3%
77,3%
85,2%
95,8%
39,0%
O Arsênio (As5+) é utilizado na fabricação de herbicidas comerciais. Para determinar o arsênio contido em uma amostra, foram realizadas várias medidas de padrões de As5+ obtendo a equação de curva analítica: Abs = 0,0305 CAs3+ + 0,0052, em que a concentração do arsênio está em mg/L. Uma amostra de 10,00 mL do herbicida foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,386. Qual a concentração de arsênio, em mg/L, presente no herbicida.
4755 mg/L de As5+
2641 mg/L de As5+
1248 mg/L de As5+
10825 mg/L de As5+
987 mg/L de As5+
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:

Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto B possui menor Rf e eluirá primeiro.
O composto A e B possui o mesmo valor de Rf.
O composto B possui o mesmo Rf do composto C.
O composto C possui menor Rf e eluirá primeiro.
O composto A possui menor Rf e eluirá por último.
Uma solução 7,25x10-5 mol/L de permanganato de potássio apresenta uma transmitância de 44,1% quando medida em uma célula de 2,10 cm no comprimento de onda de 525 nm. Calcule a absortividade molar do KMnO4.
7,25x103 L.mol-1.cm-1
8,90x103 L.mol-1.cm-1
2,34x103 L.mol-1.cm-1
1,25x103 L.mol-1.cm-1
3,58x103 L.mol-1.cm-1
A cromatografia fundamenta-se na migração diferencial dos componentes de uma mistura, o que ocorre devido a diferentes interações entre duas fases imiscíveis, sendo uma fase fixa que tem uma grande área superficial chamada fase estacionária, e a outra um fluído que se move através da fase estacionária sendo chamada de fase móvel. Na cromatografia líquida a fase móvel é líquida. (LANÇAS, 1993; DEGANI; CASS; VIEIRA, 1998).
Sendo assim, indique a alternativa que apresenta somente pontos vantajosos na aquisição do equipamento usado nesta técnica:
I- Boa sensibilidade
II- Versatilidade
III- Alta resolução;
IV- Resultados qualitativos;
V- Baixo custo de aquisição do equipamento.
Apenas I – IV – V
Apenas I – III – IV
Apenas I – II – III – IV
Apenas- I – III – V
Apenas II – IV – V
Usando a curva analítica de calibração para realizar a determinação O zinco (Zn2+) é adicionado à insulina para retardar sua velocidade de absorção para o fluxo sanguíneo. A concentração de zinco na insulina pode ser determinada por absorção atômica. Para determinação de Zn2+ em uma amostra, foram realizadas várias medidas convenientes de padrões de Zn2+, quando se obtém a seguinte equação para a curva analítica de calibração: Abs = 0,0149 CZn2+ + 0,0027 , em que CZn2+ está em mg/L. Uma amostra de 10,00 mL de insulina foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,595. Calcule a concentração, em g/L, de Zn2+ na insulina.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.

50,3%
77,3%
85,2%
95,8%
39,0%
O Arsênio (As5+) é utilizado na fabricação de herbicidas comerciais. Para determinar o arsênio contido em uma amostra, foram realizadas várias medidas de padrões de As5+ obtendo a equação de curva analítica: Abs = 0,0305 CAs3+ + 0,0052, em que a concentração do arsênio está em mg/L. Uma amostra de 10,00 mL do herbicida foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,386. Qual a concentração de arsênio, em mg/L, presente no herbicida.
4755 mg/L de As5+
2641 mg/L de As5+
1248 mg/L de As5+
10825 mg/L de As5+
987 mg/L de As5+
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:

Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto B possui menor Rf e eluirá primeiro.
O composto A e B possui o mesmo valor de Rf.
O composto B possui o mesmo Rf do composto C.
O composto C possui menor Rf e eluirá primeiro.
O composto A possui menor Rf e eluirá por último.
Uma solução 7,25x10-5 mol/L de permanganato de potássio apresenta uma transmitância de 44,1% quando medida em uma célula de 2,10 cm no comprimento de onda de 525 nm. Calcule a absortividade molar do KMnO4.
7,25x103 L.mol-1.cm-1
8,90x103 L.mol-1.cm-1
2,34x103 L.mol-1.cm-1
1,25x103 L.mol-1.cm-1
3,58x103 L.mol-1.cm-1
A cromatografia fundamenta-se na migração diferencial dos componentes de uma mistura, o que ocorre devido a diferentes interações entre duas fases imiscíveis, sendo uma fase fixa que tem uma grande área superficial chamada fase estacionária, e a outra um fluído que se move através da fase estacionária sendo chamada de fase móvel. Na cromatografia líquida a fase móvel é líquida. (LANÇAS, 1993; DEGANI; CASS; VIEIRA, 1998).
Sendo assim, indique a alternativa que apresenta somente pontos vantajosos na aquisição do equipamento usado nesta técnica:
I- Boa sensibilidade
II- Versatilidade
III- Alta resolução;
IV- Resultados qualitativos;
V- Baixo custo de aquisição do equipamento.
Apenas I – IV – V
Apenas I – III – IV
Apenas I – II – III – IV
Apenas- I – III – V
Apenas II – IV – V
Usando a curva analítica de calibração para realizar a determinação O zinco (Zn2+) é adicionado à insulina para retardar sua velocidade de absorção para o fluxo sanguíneo. A concentração de zinco na insulina pode ser determinada por absorção atômica. Para determinação de Zn2+ em uma amostra, foram realizadas várias medidas convenientes de padrões de Zn2+, quando se obtém a seguinte equação para a curva analítica de calibração: Abs = 0,0149 CZn2+ + 0,0027 , em que CZn2+ está em mg/L. Uma amostra de 10,00 mL de insulina foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,595. Calcule a concentração, em g/L, de Zn2+ na insulina.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.
4755 mg/L de As5+
2641 mg/L de As5+
1248 mg/L de As5+
10825 mg/L de As5+
987 mg/L de As5+
Na cromatográfica planar, as amostras de interesse são aplicadas no ponto de partida e arrastadas através da fase estacionária até a fase móvel atingir a parte superior da placa. Sabendo-se que o fator de retardamento pode ser definido como sendo a razão entre a distância percorrida pelas amostras e pela distância percorrida pela fase móvel. Consideremos a seguinte placa de sílica gel de TLC de compostos A, B, e C desenvolveram em hexano:

Após a determinação dos valores de Rf dos compostos A, B e C, podemos chegar à conclusão que:
O composto B possui menor Rf e eluirá primeiro.
O composto A e B possui o mesmo valor de Rf.
O composto B possui o mesmo Rf do composto C.
O composto C possui menor Rf e eluirá primeiro.
O composto A possui menor Rf e eluirá por último.
Uma solução 7,25x10-5 mol/L de permanganato de potássio apresenta uma transmitância de 44,1% quando medida em uma célula de 2,10 cm no comprimento de onda de 525 nm. Calcule a absortividade molar do KMnO4.
7,25x103 L.mol-1.cm-1
8,90x103 L.mol-1.cm-1
2,34x103 L.mol-1.cm-1
1,25x103 L.mol-1.cm-1
3,58x103 L.mol-1.cm-1
A cromatografia fundamenta-se na migração diferencial dos componentes de uma mistura, o que ocorre devido a diferentes interações entre duas fases imiscíveis, sendo uma fase fixa que tem uma grande área superficial chamada fase estacionária, e a outra um fluído que se move através da fase estacionária sendo chamada de fase móvel. Na cromatografia líquida a fase móvel é líquida. (LANÇAS, 1993; DEGANI; CASS; VIEIRA, 1998).
Sendo assim, indique a alternativa que apresenta somente pontos vantajosos na aquisição do equipamento usado nesta técnica:
I- Boa sensibilidade
II- Versatilidade
III- Alta resolução;
IV- Resultados qualitativos;
V- Baixo custo de aquisição do equipamento.
Apenas I – IV – V
Apenas I – III – IV
Apenas I – II – III – IV
Apenas- I – III – V
Apenas II – IV – V
Usando a curva analítica de calibração para realizar a determinação O zinco (Zn2+) é adicionado à insulina para retardar sua velocidade de absorção para o fluxo sanguíneo. A concentração de zinco na insulina pode ser determinada por absorção atômica. Para determinação de Zn2+ em uma amostra, foram realizadas várias medidas convenientes de padrões de Zn2+, quando se obtém a seguinte equação para a curva analítica de calibração: Abs = 0,0149 CZn2+ + 0,0027 , em que CZn2+ está em mg/L. Uma amostra de 10,00 mL de insulina foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,595. Calcule a concentração, em g/L, de Zn2+ na insulina.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.

O composto B possui menor Rf e eluirá primeiro.
O composto A e B possui o mesmo valor de Rf.
O composto B possui o mesmo Rf do composto C.
O composto C possui menor Rf e eluirá primeiro.
O composto A possui menor Rf e eluirá por último.
Uma solução 7,25x10-5 mol/L de permanganato de potássio apresenta uma transmitância de 44,1% quando medida em uma célula de 2,10 cm no comprimento de onda de 525 nm. Calcule a absortividade molar do KMnO4.
7,25x103 L.mol-1.cm-1
8,90x103 L.mol-1.cm-1
2,34x103 L.mol-1.cm-1
1,25x103 L.mol-1.cm-1
3,58x103 L.mol-1.cm-1
A cromatografia fundamenta-se na migração diferencial dos componentes de uma mistura, o que ocorre devido a diferentes interações entre duas fases imiscíveis, sendo uma fase fixa que tem uma grande área superficial chamada fase estacionária, e a outra um fluído que se move através da fase estacionária sendo chamada de fase móvel. Na cromatografia líquida a fase móvel é líquida. (LANÇAS, 1993; DEGANI; CASS; VIEIRA, 1998).
Sendo assim, indique a alternativa que apresenta somente pontos vantajosos na aquisição do equipamento usado nesta técnica:
I- Boa sensibilidade
II- Versatilidade
III- Alta resolução;
IV- Resultados qualitativos;
V- Baixo custo de aquisição do equipamento.
Apenas I – IV – V
Apenas I – III – IV
Apenas I – II – III – IV
Apenas- I – III – V
Apenas II – IV – V
Usando a curva analítica de calibração para realizar a determinação O zinco (Zn2+) é adicionado à insulina para retardar sua velocidade de absorção para o fluxo sanguíneo. A concentração de zinco na insulina pode ser determinada por absorção atômica. Para determinação de Zn2+ em uma amostra, foram realizadas várias medidas convenientes de padrões de Zn2+, quando se obtém a seguinte equação para a curva analítica de calibração: Abs = 0,0149 CZn2+ + 0,0027 , em que CZn2+ está em mg/L. Uma amostra de 10,00 mL de insulina foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,595. Calcule a concentração, em g/L, de Zn2+ na insulina.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.
7,25x103 L.mol-1.cm-1
8,90x103 L.mol-1.cm-1
2,34x103 L.mol-1.cm-1
1,25x103 L.mol-1.cm-1
3,58x103 L.mol-1.cm-1
A cromatografia fundamenta-se na migração diferencial dos componentes de uma mistura, o que ocorre devido a diferentes interações entre duas fases imiscíveis, sendo uma fase fixa que tem uma grande área superficial chamada fase estacionária, e a outra um fluído que se move através da fase estacionária sendo chamada de fase móvel. Na cromatografia líquida a fase móvel é líquida. (LANÇAS, 1993; DEGANI; CASS; VIEIRA, 1998).
Sendo assim, indique a alternativa que apresenta somente pontos vantajosos na aquisição do equipamento usado nesta técnica:
I- Boa sensibilidade
II- Versatilidade
III- Alta resolução;
IV- Resultados qualitativos;
V- Baixo custo de aquisição do equipamento.
Apenas I – IV – V
Apenas I – III – IV
Apenas I – II – III – IV
Apenas- I – III – V
Apenas II – IV – V
Usando a curva analítica de calibração para realizar a determinação O zinco (Zn2+) é adicionado à insulina para retardar sua velocidade de absorção para o fluxo sanguíneo. A concentração de zinco na insulina pode ser determinada por absorção atômica. Para determinação de Zn2+ em uma amostra, foram realizadas várias medidas convenientes de padrões de Zn2+, quando se obtém a seguinte equação para a curva analítica de calibração: Abs = 0,0149 CZn2+ + 0,0027 , em que CZn2+ está em mg/L. Uma amostra de 10,00 mL de insulina foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,595. Calcule a concentração, em g/L, de Zn2+ na insulina.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.
Apenas I – IV – V
Apenas I – III – IV
Apenas I – II – III – IV
Apenas- I – III – V
Apenas II – IV – V
Usando a curva analítica de calibração para realizar a determinação O zinco (Zn2+) é adicionado à insulina para retardar sua velocidade de absorção para o fluxo sanguíneo. A concentração de zinco na insulina pode ser determinada por absorção atômica. Para determinação de Zn2+ em uma amostra, foram realizadas várias medidas convenientes de padrões de Zn2+, quando se obtém a seguinte equação para a curva analítica de calibração: Abs = 0,0149 CZn2+ + 0,0027 , em que CZn2+ está em mg/L. Uma amostra de 10,00 mL de insulina foi diluída para 1000 mL. Essa solução quando teve sua absorbância medida, encontrou-se um valor de 0,595. Calcule a concentração, em g/L, de Zn2+ na insulina.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.
3,97
4,23
5,75
7,53
9,75
Estudantes do curso de Engenharia Química da Universidade de Uberaba se propuseram a determinar a concentração de lítio em uma liga metálica usada na produção de baterias elétricas, obtendo-se a partir de soluções padrão a seguinte equação para a curva de calibração: I = 1,594 C Li+ -0,03; onde a concentração está em μg/mL. A seguir 0,0511 g da liga metálica foi tratada convenientemente e diluída em um balão volumétrico de 500,0 mL. A análise dessa solução obteve-se uma emissão com intensidade em unidades arbitrarias de 5,72. Determine a concentração de lítio na solução preparada e o teor deste na formulação analisada.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %
Um determinado resíduo industrial, possui uma quantidade desconhecida de ACETATO DE CHUMBO Pb (C2H3O2)2. Uma amostra de 100 mL desse resíduo foi diluída em um balão de 1 L, do qual retirou-se certa quantidade para leitura em fotômetro de chama, apresentando a emissão no valor de 18,4 . Uma solução de Pb+2, com concentração de 4,27 x 10-5 mg/mL foi analisada e apresentou emissão de 12,7. Sabendo que a massa molar do acetato de chumbo é 325,29 g/mol e do íon Pb+2 é 209,98 g/mol, determine a concentração em g/L de Pb(C2H3O2)2 no resíduo industrial.
7,20 x10-3 mg/mL e 45,9 %
9,10 x10-3 mg/mL e 65,5 %
3,60x10-3 mg/mL e 3,52 %
5,50 x10-3 mg/mL e 94,5 %
6,30 x10-3 mg/mL e 5,49 %